Tìm ra chìa khóa của sự trường sinh bất lão
Một nhóm nghiên cứu quốc tế đã phân tích bộ gen của dơi – loài vật nắm bí quyết trường sinh bất lão của toàn thể giới động vật.
Thông thường tuổi thọ của một loài phụ thuộc nhiều vào kích thước của chúng và những sinh vật nhỏ bé có vòng đời rất ngắn. Điều đó không đúng với dơi tai chuột. Dù cơ thể chỉ bằng 1/648 con người nhưng chúng sống được ít nhất 20-30 năm.
Video:Telomere Sự lão hóa từ đâu!?
Dơi tai chuột thọ nhất được ghi nhận là 41 tuổi. Đặc biệt, chúng hầu như không già đi trong suốt cuộc đời.
Qua phân tích bộ gen của chúng, nhóm nghiên cứu này đã phát hiện chìa khóa nằm trong các telomere – một cấu trúc mà con người cũng sở hữu. Telomere là phần chóp nằm ở cuối đoạn DNA để bảo vệ nhiễm sắc thể khỏi bị tổn hại. Nó bị ngắn đi mỗi lần tế bào nhân bản. Khi nó ngắn đến mức không còn khả năng bảo vệ nhiễm sắc thể, tế bào già đi và không còn hoạt động hiệu quả.
Nhiều nghiên cứu ở con người trước đó đã chứng minh những tác động giúp các telomere chậm ngắn đi, ví dụ việc sinh con ở phụ nữ, sẽ giúp con người chậm lão hóa.
Loài dơi lại sở hữu một gen đặc biệt khiến cho nó có thể tự sửa chữa telomere. Telomere của loài dơi bị ngắn đi cực kỳ chậm và khiến chúng trở nên trường sinh bất lão so với các họ hàng có cùng kích thước.
Tác giả Emma Teeling đến từ University College Dublin cho biết có thể dơi đã tìm ra cách để kéo dài nhiễm sắc thể mà không gây ung thư. Nhóm nghiên cứu sẽ cần thêm thời gian để giải thích rõ ràng cơ chế bị ẩn này cũng như sử dụng nó cho những nghiên cứu cao hơn, ví dụ tìm cách ứng dụng lên việc bảo vệ sức khỏe con người.
Nghiên cứu được công bố trên tạp chí khoa học Science Advances.
Telomere – Telomerase và giải Nobel y học
Ngày 5/10/2009, Giải Nobel y học năm 2009 đã được trao cho ba nhà khoa học Mỹ với công trình phát hiện và giải mã vai trò bảo vệ ADN của telomere và telomerase và quá trình lão hóa tế bào.
Ngày 5/10/2009, Giải Nobel y học năm 2009 đã được trao cho ba nhà khoa học Mỹ với công trình phát hiện và giải mã vai trò bảo vệ ADN của telomere và telomerase và quá trình lão hóa tế bào. Các nhà khoa học đã đưa ra câu trả lời rằng vấn đề cốt lõi nằm ở các đầu của chromosome - telomere - và một enzym hình thành nên chúng - telomerase.
Quá trình lão hóa tế bào
Trong sinh học, lão hóa (tiếng Anh: senescence, xuất phát từ senex trong tiếng Latin có nghĩa là "người già" hay "tuổi già") là trạng thái hay quá trình tạo nên tuổi tác già nua. Lão hóa là quá trình tất yếu diễn ra trong cơ thể con người. Nguyên nhân gây lão hóa được giải thích bằng nhiều thuyết khác nhau: thuyết di truyền, thuyết gốc tự do... Ngoài ra, hiện tượng lão hóa có liên quan đến đột biến gen còn gây hội chứng già trước tuổi hay liên quan đến tuổi thọ con người. Quá trình lão hóa diễn ra ở mọi cơ quan trong cơ thể và gây ra những hậu quả rất nghiêm trọng. Tuy nhiên nếu thực hiện tích cực một số biện pháp, chúng ta có thể trì hoãn quá trình lão hóa. Trong các học thuyết kể trên, thuyết di truyền được quan tâm hơn cả do được đánh giá là có tính khoa học nhất. Theo thuyết này thì con người có sẵn trong các tế bào của mình một chương trình - mang trong các "gen". Các gen hoạt động theo thứ tự, bất di bất dịch: sinh, lão, bệnh, tử.
Chức năng và sự tổng hợp telomere
Các telomere
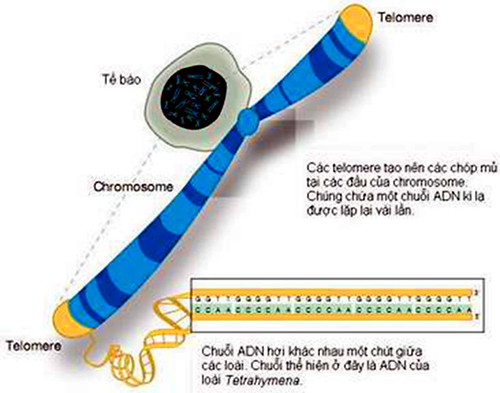
Các phân tử ADN có cấu trúc xoắn kép, mang gen của chúng ta được đóng gói thành các chromosome. Từ những năm 1930, hai nhà khoa học Hermann Muller (giải Nobel năm 1946) và Barbara McClintock (giải Nobel năm 1983) đã phát hiện thấy ở động vật có vú, các đầu tận cùng của nhiễm sắc thể được bảo vệ bằng các telomere (theo tiếng Hy Lạp, telo có nghĩa là cuối, còn mere là phần), tức là những cấu trúc đặc biệt được hình thành bởi các chuỗi TTAGGG lặp lại kế tiếp nhau. Ở người các chuỗi lặp lại của telomere có từ 5.000 đến 15.000 base. Telomere có nhiệm vụ bảo đảm sự bền vững của các chromosome, chống lại thoái hóa tế bào, chống lại sự tái tổ hợp sai lạc và có vai trò điều hòa gen.
Các tế bào sống của người bình thường không nhất thiết phải phân chia thường xuyên khiến các nhiễm sắc thể vẫn duy trì một chiều dài các telomere một cách tương đối nhưng nói chung đều có một đời sống có giới hạn. Thông thường tế bào chết đi sau 40-60 chu kỳ sao chép. Thời gian sống của mỗi tế bào được quyết định về di truyền học bởi hai hệ thống độc lập với nhau. Tuy nhiên, trong quá trình phân chia, một phần cuối của các chuỗi ADN lại không có khả năng sao chép được và vì thế sau mỗi lần phân chia, các nhiễm sắc thể đều bị ngắn đi do mất một số lượng ADN của telomere (khoảng chừng 50-100 base), vì thế có nhà khoa học ví quá trình này giống như sự xổ ra ở đầu sợi dây giầy. Khi các telomere trở nên quá ngắn thì các nhiễm sắc thể sẽ kém bền vững, chúng không thể bám vào được màng nhân tế bào, bị dính vào nhau và có hình dạng kỳ dị. Hậu quả là các tế bào không thể phân chia được nữa. Các nhà khoa học nhận thấy nếu các telomere liên tục ngắn lại thì tế bào sẽ lão hóa nhanh. Ngược lại, nếu telemore giữ nguyên độ dài thì tế bào sẽ sống bền lâu. Nhưng nếu các tế bào bền vững một cách bất thường sẽ trở thành các tế bào ung thư.
Elizabeth Blackburn và Jack Szostak đã phát hiện ra một chuỗi ADN nhất định trong telemore chính là người lính bảo vệ cho nhiễm sắc thể không bị hao hụt và già cỗi.
Enzym telomerase
Tiếp theo nghiên cứu của Blackburn, Greider và Blackburn đã nghiên cứu xem cơ chế hình thành telomere diễn ra như thế nào và hai người đã phát hiện ra telomerase - một enzym (bao gồm cả RNA lẫn protein) có vai trò giúp các phân tử ADN sao chép toàn bộ nhiễm sắc thể mà không bị mất đi đoạn cuối cùng. Và họ khẳng định rằng telomerase sẽ chỉnh sửa lại quá trình phân chia tế bào, giúp tái sinh phần đầu của nhiễm sắc thể.
Thành phần ARN của telomerase người có chừng 445 nucleotid, trong đó các nucleotid 46-56 là vị trí gắn vào đầu cùng của telomere, và đó là khuôn để từ đó thêm vào các ADN của telomere. Cơ chế bảo vệ telomere là enzym telomerase sẽ nhận dạng đầu cùng của telomere thông qua các hoạt động giữa telomere và cả 2 tiểu đơn vị hTR và hTERT của telomerase, nhận dạng xong thì thêm chuỗi sáu base TTAGGG của telomere, như vậy là kéo dài thêm một telomere và cứ thế tiếp tục.
Và cơ sở cho những phương pháp điều trị mới
Telomere bị gãy là lời giải thích tại sao khả năng sinh sản tự nhiên giảm theo tuổi và phụ nữ cao tuổi hơn có nguy cơ sinh ra những đứa trẻ mang một số nhiễm sắc thể bị lỗi (chẳng hạn như trẻ mắc hội chứng Down) thậm chí ngay ở một độ tuổi ngang nhau sự khác biệt về độ dài telomere sẽ khiến những phụ nữ có telomere ngắn có thể gặp khó khăn nhiều hơn trong thụ thai. Mặt khác, sự có mặt của enzym telomerase hoạt tính ở tế bào gốc và tế bào ung thư được xác định chính là nguyên nhân khiến cho tế bào phân chia liên tục và có cuộc sống vĩnh cửu do kéo dài các chuỗi ADN của telomere. Thậm chí, một số bệnh di truyền được cho là do telomerase bị hỏng dẫn đến sự bất thường của các tế bào. Nghiên cứu của các nhà khoa học cũng giúp giải thích bản chất của tình trạng lão hóa. Điều này mở ra một khám phá của những phương pháp điều trị mới.
Với bệnh ung thư, do việc xác định nguyên nhân là tích trữ nhiều enzym telomerase cũng chiều dài các telomere quá lớn nên một ý tưởng điều trị căn bệnh này là xóa bỏ bớt các telomerase kết hợp với việc nghiên cứu, phát minh và sử dụng các vaccin chống lại sự hoạt động thái quá của loại enzym này.
Với các bệnh di truyền khác được biết đến có nguyên nhân bởi sự sai lệch của các telomere như bệnh thiếu máu ác tính bẩm sinh, các bệnh về da, vô sinh... cũng có thể sử dụng nguyên lý sửa sang các khiếm khuyết telomere và telomesare để điều trị.
| Ba nhà khoa học đoạt giải Nobel y học 2009 GS. Elizabeth H. Blackburn, người Mỹ, sinh năm 1948 tại Hobart, Tasmania, Australia. Tốt nghiệp Đại học Melbourne, lấy bằng tiến sĩ vào năm 1975 ở Trường đại học Cambridge, Anh, giảng dạy và nghiên cứu tại trường Đại học Yale, New Haven, Đại học California, Berkeley, Mỹ. Từ năm 1990 là giáo sư sinh vật học và sinh lý học tại trường Đại học California, San Francisco. |
 |
| GS. Carol W. Greider, người Mỹ, sinh năm 1961 tại San Diego, California, Mỹ. Bà học tại trường Đại học California ở Santa Barbara và ở Berkeley, lấy bằng tiến sĩ vào năm 1987 với sự hướng dẫn của GS. Blackburn. Năm 1997 được phong hàm giáo sư sinh học phân tử và di truyền học tại Trường Y khoa thuộc Trường đại học Johns Hopkins ở Baltimore vào năm 1997. |  |
| GS. Jack W. Szostak người Mỹ, sinh năm 1952 tại London, Anh, lớn lên ở Canada. Ông học trường Đại học McGill ở Montreal và trường Đại học Cornell ở Ithaca, New York, lấy bằng tiến sĩ năm 1977. Ông làm việc tại trường Y khoa Harvard từ năm 1979 và hiện tại là giáo sư di truyền học tại Bệnh viện Đa khoa Massachusetts ở Boston. Ông còn là hội viên của Viện Y khoa Howard Hughes | "> |
Telomere
I. TELOMERE:
1. Telomere là gì?
Trong cơ chế tái bản, DNA được tổng hợp theo hai mạch song song nhau. Sự tháo xoắn được thực hiện từ đầu nọ đến đầu kia của DNA với sự xúc tác của enzyme helicase. Theo tinh thần tiết kiệm và tranh thủ phổ biến trong tất cả các hoạt động sinh lí của cơ thể, mạch kép của DNA tháo xoắn đến đâu, sẽ được các phức hệ enzyme DNA – polymerase I, DNA – polymerase II, DNA – polymerase III và các enzyme khác xúc tác tổng hợp mạch mới ngay đến đó. Vấn đề xuất hiện ở đây là, trong cả 3 hệ enzyme trên đều không có đầu 3’-OH tự do là nơi để các nucleotide tiếp theo liên kết vào, một điều kiện tối cần thiết để chúng có thể thực hiện quá trình tổng hợp kéo dài mạch. May thay, trong tế bào lại có một hệ enzyme khác, RNA – polymerase, tự nó có đầu 3’-OH tự do và do đó có khả năng khởi đầu quá trình tổng hợp kéo dài mạch. Vì thế, cơ chế tự nhân đôi trong nhân tế bào đã “mượn tạm” hệ enzyme này thực hiện quá trình tổng hợp ra đoạn nhỏ mạch RNA (các primer – RNA mồi) bổ sung với mạch khuôn DNA, nhằm tạo đầu 3’-OH tự do giúp DNA – polymerase thực hiện chức năng của mình. Tuy nhiên, việc khắc phục “nhược điểm” này lại để lộ ra một “nhược điểm” khác trong cơ chế tái sinh ở cấp độ phân tử – sự tái bản DNA.
Do mạch DNA chỉ có thể được tổng hợp theo chiều từ 5’ đến 3’ (dưới tác dụng của DNA – polymerase khi trượt trên mạch khuôn theo chiều 3’ – 5’), nên sự tái bản trên hai mạch đơn của DNA diễn ra không giống nhau:
• một mạch được tổng hợp liên tục cùng chiều với sự tháo xoắn DNA gọi là mạch dẫn đầu (leading strand) với chỉ một đoạn primer cho mỗi vị trí khởi sự tái bản (điểm ori);
• một mạch được tổng hợp gián đoạn ngược chiều với sự tháo xoắn DNA gọi là mạch ra chậm (lagging strand hay mạch Okazaki) vớinhiều đoạn primer khởi đầu cho từng phân đoạn Okazaki có chiều dài khoảng 1000 – 2000 cặp nucleotide. Các primer này dài từ hàng chục đến hàng trăm nucleotide. Trên mạch ra chậm, sau khi hoàn tất quá trình tổng hợp các phân đoạn Okazaki, DNA – polymerase I với hoạt tính exonuclease sẽ vừa phân giải các primer, vừa tổng hợp đoạn DNA thay thế dựa trên đầu 3′-OH của đoạn DNA đã tổng hợp trước đó.
Như vậy, sau khi kết thúc quá trình tổng hợp kéo dài, tận cùng của DNA ở hai đầu 3’ (của mạch DNA cũ) vẫn còn tồn tại một primer chưa được thay thế. Và các primer này sẽ được các enzyme loại bỏ mà không được thay thế do sự khiếm khuyết của hệ enzyme DNA – polymerase khi không có khả năng tạo đầu 3’-OH trong phức hệ. Chính điều này làm cho hai đầu của DNA bị ngắn đi một đoạn tương ứng với chiều dài của primer (vài chục đến hàng trăm nuceotide) sau mỗi lần nó tự nhân đôi (tương ứng với sự phân chia tế bào). Vậy là, hệ gene của tế bào sẽ bị “thất thoát” sau mỗi lần tạo ra thế hệ mới. Tế bào đã làm cách nào để khắc phục sai sót này?
Các nghiên cứu đã chỉ ra rằng, trong DNA tồn tại những đoạn trình tự lặp lại có chiều dài nhất định ở hai đầu “dự trữ” cho sự mất mát này, nhằm đảm bảo an toàn cho những gene cấu trúc nằm bên trong. Đây chính là các telomere.
Telomere là những trình tự lặp lại của DNA ở các đầu mút của nhiễm sắc thể. Mặc dù cũng được cấu thành từ các đơn phân nucleotide, nhưng telomere không mã hóa cho protein. Ngoài chức năng trên, chúng còn bảo vệ các nhiễm sắc thể trong quá trình phân bào, giữ cho các nhiễm sắc thể không dính vào nhau.
2. Lịch sử tìm thấy telomere:
3. Cấu tạo telomere:
Telomere được tìm thấy trong hầu hết các tế bào nhân thực và một vài tế bào loài sinh vật nhân sơ.
Sinh vật nhân thực (Eukaryote) có nhiễm sắc thể dạng mạch thẳng, và vì vậy mà gặp phải những vấn đề trong quá trình tái bản ở hai đầu mút mỗi nhiễm sắc thể như đã nói ở trên. Sinh vật nhân sơ (Prokaryote) có DNA dạng vòng, nên không có các đầu tận cùng, mà vì vậy cũng không có các telomere trừ một số trường hợp ngoại lệ. Tuy nhiên, ở những vi khuẩn có telomere, cấu trúc và chức năng của chúng lại không giống ở sinh vật nhân thực.
Đặc điểm cấu tạo của telomere:
• Có các protein đặc trưng liên kết ở phần đuôi của nhiễm sắc thể.
< • Phần DNA tận cùng của nhiễm sắc thể ở dạng sợi đơn, mang trình tự lặp, cuộn lại thành dạng kẹp tóc.
Những đặc điểm nay không có ở telomere của các sinh vật nhân sơ.
Telomere trên DNA mạch thẳng được tạo thành từ trình tự lặp TTAGGGtrên một mạch cùng trình tự bổ sung trên mạch còn lại (AATCCC). Một đoạn telomere là một đoạn lặp đi lặp lại của 6 cặp nitrogenous base (bazơ nitơ). Telomere ở tế bào người thông thường có khoảng 16 đoạn lặp lại như thế.
Ví dụ: Trong tế bào máu của người, độ dài của các telomere biến đổi như sau:
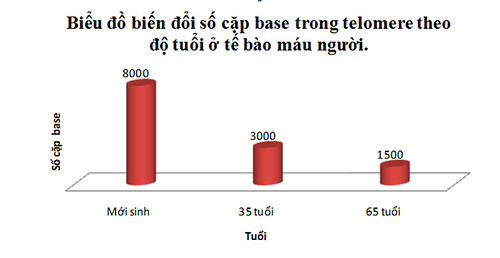
Mỗi lần phân bào, bình quân một người mất 30 – 200 cặp base ở các telomere của tế bào đó. Những tế bào bình thường chỉ có thể phân chia khoảng 40 – 70 lần cùng với sự ngắn dần của các telomere cho đến khi lão hóa, chết hoặc duy trì những sai sót di truyền dẫn đến ung thư. Cũng có những trường hợp telomere không bị ngắn đi. Chẳng hạn như trong mô cơ tim, do chúng không liên tục phân chia.
4. Chức năng của telomere:
Như vậy, có tthể tóm gọn lại chức năng của telomere:
– Giúp tế bào phân chia mà không làm mất gene. Nếu không có telomere, những gene cấu trúc qui định những tính trạng của cơ thể sẽ bị rút ngắn dần sau mỗi lần phân bào.
– Giữ cho các nhiễm sắc thể không bị dung hợp với nhau hoặc tự dung hợp ở những vị trí tận cùng. Khi cắt bỏ đoạn telomere ở 2 đầu của các nhiễm sắc thể, người ta phát hiện ra nhiều nhóm nhiễm sắc thể dính nhau ở đầu tận cùng, hoặc tự dính vào nhau ở 2 đầu gây nên sự khép vòng. Chức năng này có được do sự hình thành cấu trúc kẹp tóc trong telomere: phần DNA tận cùng cuộn xắn lại, giúp cho những phần DNA mạch đơn không thể kết cặp bổ sung một cách ngẫu nhiên với nhau.
– Khi đầu tận cùng của nhiễm sắc thể mất telomere, tế bào sẽ nhận diện đầu tận cùng có vẻ như bị sai hỏng (không có sự lặp lại của trình tự TTAGGG) và tiến hành các hoạt động sửa sai phần mà thực ra không có sự sai sót nào. Kết quả có thể làm dừng quá trình tự nhân đôi, thậm chí gây chết!
– Một số bệnh di truyền ngày nay được biết là do những khuyết tật của enzyme telomerase – enzyme dảm trách việc tổng hợp kéo dài đoạn telomere, duy trì tuổi thọ của các tế bào có sự tồn tại của enzyme này.
Ví dụ:
• Các dạng chính của bệnh thiếu máu bẩm sinh do tế bào gốc trong tủy xương phân chia không đủ cung cấp cho cơ thể
• Những bệnh di truyền chủ yếu trên da và phổi.
• Một vài căn bệnh gây già sớm.
5. Sự hình thành phức hệ protein – telomere ở tận cùng nhiễm sắc thể (telomere capping):
Ngoài chức năng duy trì tuổi thọ của tế bào bằng cách kéo dài thời gian tồn tại an toàn của các gen cấu trúc khi đầu mút nhiễm sắc thể “mòn” dần qua các lần phân bào, telomere còn có chức năng giữ cho các nhiễm sắc thể không bị dung hợp với nhau (fusion). Chức năng này có được là do sự hình thành phức hợp liên kết giữa các protein đặc trưng với đoạn telomere.
Các vùng giàu Guanine trên telomere chính là trung tâm giúp cho cấu trúc này được hình thành. Chúng đóng vai trò là điểm đính của các protein, được gọi là các vị trí liên kết (binding sites). Những vị trí này có cấu trúc đặc trưng cho việc đính những protein đặc hiệu phục vụ cho việc bảo vệ đầu tận cùng của telomere. Các protein hoạt động bằng cách vừa che chắn phần cuối của telomere (capping the telomere ends), vừa tham gia vào cấu hình của các cấu trúc telomere phức tạp hơn. Một cách tổng quát, các protein đóng góp vai trò vào việc bảo vệ phần tận cùng của nhiễm sắc thể khỏi sự dung hợp với các nhiễm sắc thể khá, hoặc bảo vệ chúng khỏi sự tấn công của các enzyme polimerase có hoạt tính exonuclease (phân giải acid nucleic từ đầu 3′-OH hoặc 5’OH).
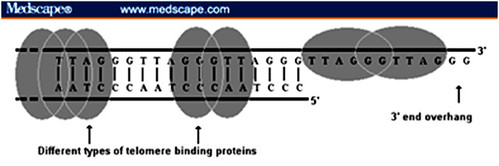
– Quan niệm ban đầu về quá trình “đóng gói” telomere (telomere capping):
Nhằm đảm bảo vai trò bảo vệ các gene ở đoạn giữa nhiễm sắc thể, phần mạch kép của telomere sẽ được gắn với những protein chuyên biệt gọi là duplex DNA binding proteins (Raplp, TRF1 …) trong khi phần mạch đơn được “bao gói” bằng nhóm end-specific telomere protein (Oxytricha α/β). Như hình minh họa sau:
– Quan niệm hiện đại (được phát hiện từ năm 1999 – 2004):
Telomere có cấu trúc phức tạp hơn nhiều, và hoàn toàn đảm bảo cho việc tránh khỏi sự dung hợp của các nhiễm sắc thể tại các đầu tận cùng của chúng. Theo quan niệm này, phức hợp telomere – protein có sự tham gia cấu trúc của cả DNA và protein. Căn cứ vào sự hiện diện và vị trí của mỗi protein trong thành phần phức hợp, cơ thể sẽ “để yên” cho những đoạn DNA “lạ” mà không nhận diện chúng là những đoạn bị lỗi để rồi thực hiện sự sửa sai không cần thiết, thậm chí có thể gây sai hại nghiêm trọng.
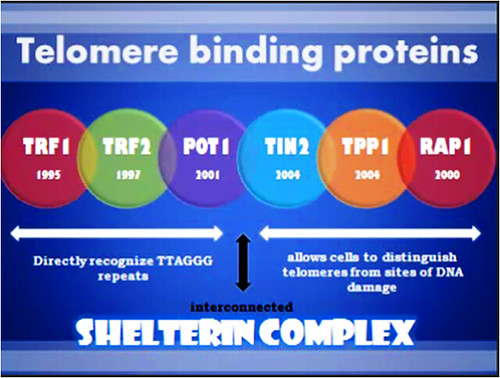
Thành phần cơ bản của phức hệ protein trên telomere (shelterin complex hay telosome) được biểu hiện trong hình sau:

Telomere binding proteins: TRF1, TRF2, POT1, TIN2, TPP1, RAP1.
Có rất nhiều enzyme tham gia vào thành phần của phức hệ shelterin (shelterin complex), trong đó có những thành phần chủ yếu:
• Nhóm bám trên các trình tự TTAGGG bằng cách nhận diện trực tiếp: TRF1, TRF2, POT1. • Nhóm các protein cho phép tế bào phân biệt telomere với những phần DNA bị sai hỏng (không có gắn những thành phần này): TIN2, TPP1, RAP1.
5.1. Telomeric Repeat Binding Factor 1 (TRF1):
Gắn vào mạch kép bằng cách nhận diện những trình tự lặp đặc trưng của telomere.
5.2. Telomeric Repeat Binding Factor 2 (TRF2):
Gắn vào để kết nối đoạn mạch đơn và đoạn mạch kép trong telomere, làm cho telomere cong lại như hình một chiếc kẹp giấy. Chúng cũng đi kèm với TRF1 trong telosome
5.3. Protection of Telomere 1 (POT1):
Gắn vào mạch đơn của DNA và trùm lấy phần cuối của đoạn mạch kép trong telomere, đảm bảo cho phần này không bị tổn thương, hoặc bị kích thích tiến hành tổng hợp tiếp tục thành mạch kép.
5.4. Telomere Protecting Protein 1 (TPP1):
Tương tác với POT1.
5.5. TIN2:
Tương tác với TPP1
5.6. RAP1:
Tương tác với TIN2 và TRF2.
Sau khi hoàn tất quá trình gắn kết protein vào telomere, mô hình cấu trúc phức hợp có dạng như sau:

Telomere với các telosome gắn vào giữ hình dạng “cái kẹp tóc”
Các protein trên bám dọc suốt telomere. Một nhóm gồm các thành phần này gọi là telosome (hay shelterin). Nhờ sự bảo vệ chặt chẽ của các protein cùng cấu trúc “cài then” mà telomere giúp các nhiễm sắc thể không có “cơ hội” gắn kết với nhau ở đầu tận cùng của chúng. Khi thực hiện thí nghiệm cắt bỏ telomere, người ta thấy các nhiễm sắc thể bị dung hợp với nhau ở đầu tận cùng. Trong thực tế, điều này sẽ gây ra những đột biến dị bội.

Sự dung hợp của các nhiễm sắc thể khi thực hiện thí nghiệm cắt bỏ telomere
6. Telomere và sự lão hóa:
Trong tế bào sinh dưỡng thông thường, cứ sau mỗi lần phân chia, telomere sẽ bị ngắn đi một đoạn khoảng 30 – 200 cặp nucleotide. Do đó, sau một khoảng thời gian nhất định khoảng 40 – 70 lần phân chia, những “chiếc nón sắt bảo vệ nhiễm sắc thể” này sẽ “mòn”, để lộ phần nhiễm sắc thể mang thông tin di truyền bên trong gây ra các sai sót nghiêm trọng đối với hệ gene, làm ngừng quá trình tự nhân đôi, hoặc thậm chí gây chết tế bào. Đây là lúc tế bào (kéo theo cơ thể) rơi vào quá trình lão hóa (senescence).
Sky+Theo: Nobelprize.org và Telomere.net, Internet





























Không có nhận xét nào:
Đăng nhận xét
Những người bạn